Muestra. Siembra extensión en superficie

Preparación de la muestra
Hacer una dilución 1/50 de la muestra de orina.
Para ello depositar 0,5
mL de orina en un matraz que contiene 24,5 mL de diluyente estéril.
Sembrar 0,1 mL de la dilución 1/50 en
Agar CLED
y en Agar Sangre por la técnica de siembra en superficie.
Agar CLED. Agar Cistina Lactosa Deficiente en Electrolitos. Este agar se utiliza porque permite el crecimiento de la
mayoría de los patógenos urinarios y evita el crecimiento invasivo de Proteus.
Agar Sangre: Es un agar que permite el crecimiento de microorganismos difíciles (Staphylococcus y
Streptococcus) que no son capaces de crecer en otros medios como el agar CLED).
Siembra en agar CLED y agar sangre. Recuento
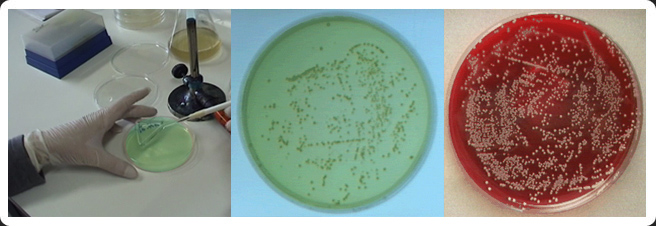
Recuento
Incubar a 37 ºC /24 horas (Observar el crecimiento en Agar CLED y
anotar si es un microorganismo Lactosa positivo o Lactosa negativo)
Elegir la placa que tenga más colonias y contarlas todas.
Expresar el resultado como ufc/mL de orina.
Cálculo
número de colonias x 10 x 50= UFC /mL de orina
Si el número de colonias en la placa es más de 300 el resultado será: más de 150.000 UFC/mL de orina.
Si el número de microorganismos es:
Mayor de 105 /mL. Hay infección urinaria
Menor de 103/mL. No hay infección urinaria.
Entre 103 y 104/mL. Resultado dudoso. Se aconseja repetir el análisis.
Entre 104 y 105/mL. Posible infección,continuar con el análisis.
Tinción de Gram y Observación al microscopio. Aislamiento mediante siembra en estría.

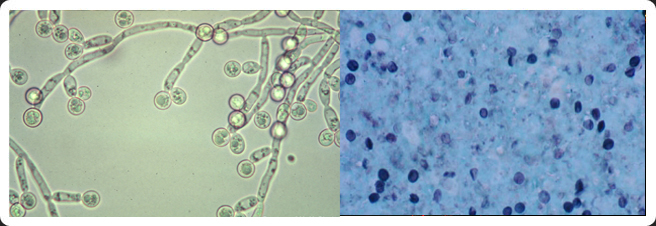
Observación macroscópica, microscópica y aislamiento
A partir de una colonia crecida en agar CLED
hacer una Tinción de Gram
y sembrar para asilamiento por siembra en estría. Si se trata de una levadura, aislar en agar Sabouraud.
Incubar a 28 ºC de
24- 48 horas.
Realizar la observación de hifas al microscopio.
Identificación con Galería API 20C AUX
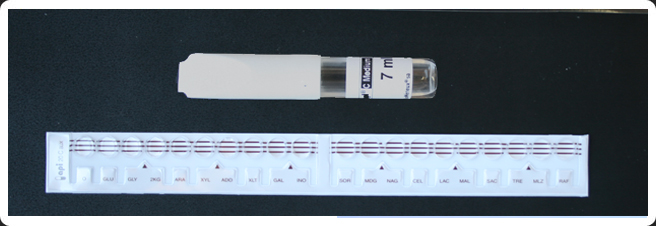
Galería API 20 C AUX.
A partir de una colonia crecida en agar Sabouraud inocular una galeria API 20C AUX.
La galería API 20 C AUX (bioMérieux) se
compone de 19 pocillos con sustratos deshidratados
que permiten realizar 19 pruebas de asimilación.
Los pocillos se inoculan con un medio mínimo semisólido
y las levaduras sólo se reproducen si son
capaces de utilizar el sustrato correspondiente.
Permite identificar un total de 34
especies diferentes de levaduras patógenas.
La lectura de estas reacciones se hace por
comparación con un control de crecimiento y la
identificación se obtiene, a partir de un código
numérico, mediante un catálogo analítico o un programa
informático
Galería API 20C AUX. Procedimiento
 Procedimiento
Procedimiento
1. A partir de un cultivo joven de la levadura a identificar,
realizar una suspensión en 2 ml de agua
destilada estéril hasta obtener una turbidez igual a
2 de McFarland.
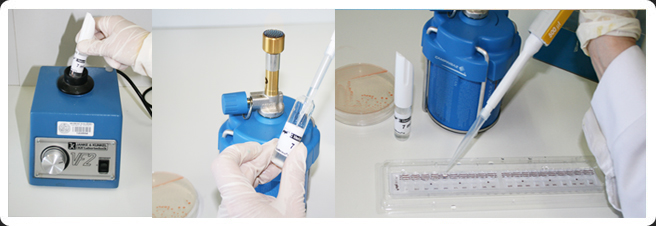
2. Transferir 100 microlitros (2 gotas) de esta suspensión a
una ampolla de C Medium y homogeneizar evitando
la formación de burbujas.
3. Llenar los pocillos con la suspensión anterior evitando
la formación de burbujas y creando un nivel
horizontal para generar resultados correctos.
4. Incubar a 28-30 ºC durante 48-72 h.
Lectura e Interpretación de resultados
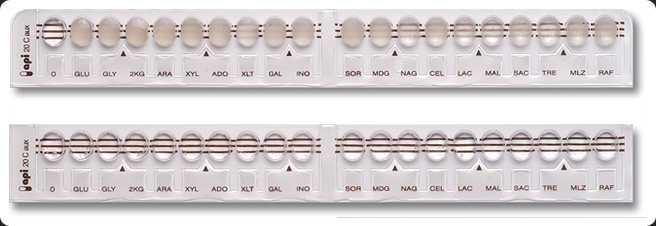
LECTURA E INTERPRETACIÓN.
Observar el crecimiento de las levaduras en comparación
con la cúpula del control negativo. Una
cúpula más turbia que el testigo indica una reacción
positiva que debe anotarse en la hoja de
resultados.
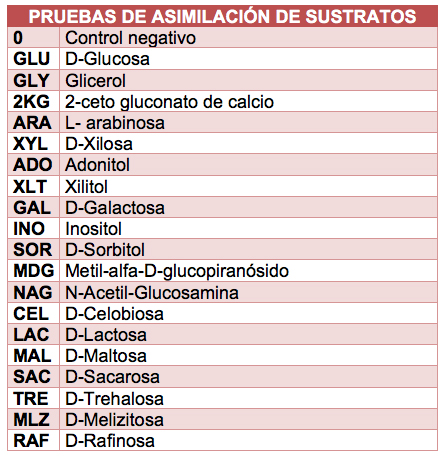
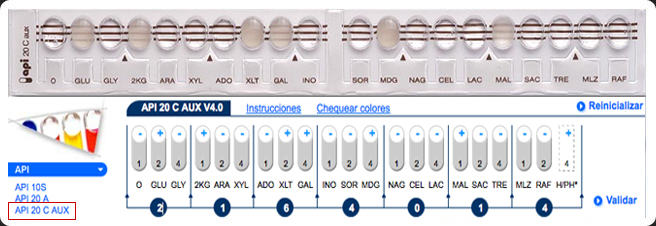
INTERPRETACIÓN DE LOS TRIPLETES.
En la hoja de resultados, los diferentes nutrientes
están separados en grupos de tres y se adjudica
a cada uno, en caso de ser positivo, un valor
diferente: 1 para el primero, 2 para el segundo y 4
para el que ocupa el tercer lugar.
Sumando cada
triplete se obtiene un número de siete cifras que
constituye el perfil numérico. El séptimo dígito se obtiene teniendo en cuenta los resultados de la observación al microscopio de las hifas.
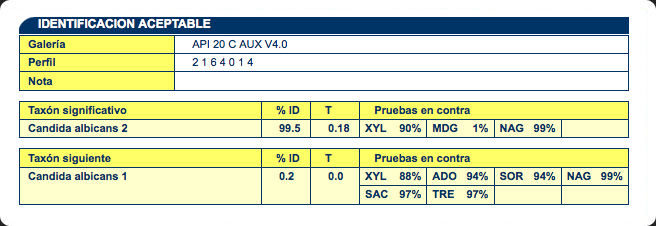
IDENTIFICACIÓN
La identificación debe hacerse mediante el
Catálogo Analítico o el Programa Informático de
Identificación suministrado por el fabricante.










