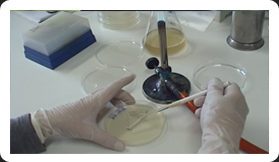
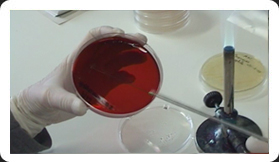
Siembra por extensión en superficie
VER VíDEO. Depositar sobre la superficie de una placa con agar nutritivo una gota ó 0,1 ml de una determinada dilución del cultivo de microorganismos problema y extenderlo con ayuda del asa de Drigalsky, previamente esterilizada, en todas las direcciones hasta que esté completamente seco. Incubar la placa, en posición invertida, a la temperatura deseada (durante 24, 48 ó 72 horas) según el tipo de microorganismo. La posición invertida evitará que el agua de condensación se deposite sobre la superficie del medio, dificultando la obtención de colonias aisladas.
Siembra en estría
VER VÍDEO. Con un asa de siembra, previamente esterilizada, se toma una muestra del cultivo de microorganismos y se extiende sobre un área pequeña de la superficie de la placa con agar nutritivo, en forma de estrías muy juntas, pero sin hacer presión para no dañar el agar. Se esteriliza el asa, se enfría y después de rozar la siembra realizada previamente, se extiende de nuevo por otra zona de la placa haciendo nuevas estrías. Este proceso se repite sucesivamente, esterilizando y enfriando el asa al comienzo de las sucesivas siembras en estría. Se lleva la placa a incubar, a la temperatura adecuada, siempre en posición invertida.
Tinción de Gram
VER VÍDEO. Con el asa de siembra, previamente flameada, tomar un poco de muestra. En una lámina portaobjetos hacer el extendido en espiral. Dejar secar a temperatura ambiente. Fijar la muestra con metanol durante un minuto o al calor. Agregar azul violeta (cristal violeta o violeta de genciana) y esperar 1 min. Quitar el exceso de colorante. Todas las células gram positivas y gram negativas se tiñen de color azul-purpura. Agregar lugol y esperar entre 1 minuto. Agregar acetona y/o alcohol 96º y esperar unos segundos (parte critica de la coloracion). Enjuagar con agua. Tinción de contraste agregando safranina o fucsina básica y esperar 1-2 min. Este tinte dejará de color rosado-rojizo las bacterias Gram negativas. Enjuagar con agua y dejar secar. Para observar al microscopio óptico es conveniente hacerlo a 100x con aceite de inmersión.
Procedimiento Galeria API 20C AUX
VER VíDEO. A partir de un cultivo joven de la levadura a identificar, realizar una suspensión en 2 ml de agua destilada estéril hasta obtener una turbidez igual a 2 de McFarland. Transferir 100 microlitros (2 gotas) de esta suspensión a una ampolla de C Medium y homogeneizar evitando la formación de burbujas. Llenar las cúpulas con la suspensión anterior evitando la formación de burbujas y creando un nivel horizontal para generar resultados correctos. Incubar a 28-30 ºC durante 48-72 h. Observar el crecimiento de las levaduras en comparación con la cúpula del control negativo. Una cúpula más turbia que el testigo indica una reacción positiva que debe anotarse en la hoja de resultados.